Dortmund, 14. Februar 2025
Besondere Verbindungen gibt es nicht nur im romantischen Sinne, auch in der Forschung kommen sie immer wieder vor. Die Redaktion hat ISAS-Forschende gefragt, welche Liaison im Labor ihre Herzen höherschlagen lässt. Für die ISAS-Arbeitsgruppe Bioimaging ist die Antikörper-Epitop-Bindung so ein „perfektes Match“. Antikörper sind Y-förmige Proteine, die vom Immunsystem gebildet werden. Sie binden an Krankheitserreger oder fremde Moleküle, um sie zu markieren oder direkt zu neutralisieren. Diese Bindung entsteht nach einem sehr spezifischen System. Jeder Antikörper besitzt eine bestimmte Region mit einer hochpräzisen, dreidimensionalen Struktur, die genau zum Epitop des Antigens passt. Das Epitop ist der spezifische Teil des Antigens, an den der Antikörper bindet. Diese Bindung ähnelt dem Schlüssel-Schloss-Prinzip. Durch die hohe Spezifität geht der Antikörper also fast ausschließlich nur Bindungen mit einem bestimmten Epitop – und damit einem bestimmten Antigen ein – ein perfektes Duo also.
Schon minimale Veränderungen in der Struktur des Epitops können eine Bindung beeinflussen oder sogar verhindern. Diese hohe Präzision ist vor allem entscheidend für die Funktion unseres Immunsystems. Antikörper müssen genau zwischen körpereigenen und fremden Strukturen unterscheiden, um eine effektive Immunantwort auszulösen, ohne eben gesundes Gewebe anzugreifen.
Immunfluoreszenz – anregender Alltag beim Bioimaging
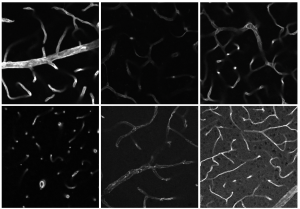
Diesen sehr spezifischen Mechanismus nutzt die Bioimaging Arbeitsgruppe fast täglich für ihre Forschung. Wichtig ist das zum Beispiel für die Immunfluoreszenz, eine Methode, die spezifische Proteine in Geweben oder Zellen sichtbar machen kann. „Die Immunfluoreszenz ist eine unserer Standardtechniken, um definierte Proteine, Lipide und andere Zielstrukturen in unseren biologischen Proben visualisieren und lokalisieren zu können“, sagt Prof. Dr. Anika Grüneboom, Leiterin der Forschungsgruppe Bioimaging.
Die Biolog:innen verwenden Antikörper, an die bestimmte Fluoreszenzfarbstoffe gekoppelt sind. Durch die Anregung, zum Beispiel mit Lasern, wird Licht bestimmter Wellenlängen von den Fluorophoren (s. Infobox) ausgesendet. Die Forschenden können diese emittierten Photonen (quasi Lichtteilchen) entsprechend messen. Wenn die markierten Antikörper also an ihr Zielprotein binden, können die Wissenschaftler:innen mithilfe von Fluoreszenzmikroskopen Strukturen auf subzellulärer Ebene sichtbar machen. Dadurch können sie die räumliche Verteilung von Proteinen in biologischen Proben genau analysieren.

Prof. Dr. Anika Grüneboom leitet am ISAS die Forschungsgruppe Bioimaging sowie das Forschungsprogramm 3D-Molekulare Pathologie.
© ISAS / Hannes Woidich
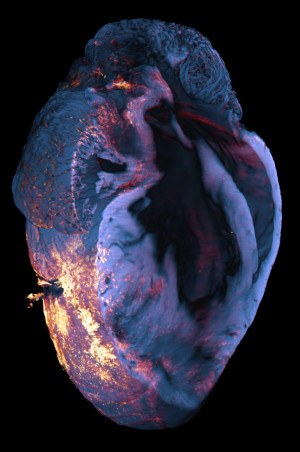
Das Foto zeigt das Herz einer Maus nach einem Herzinfarkt. Aufgenommen wurde es mit einem Lichtblatt-Fluoreszenzmikroskop. Um die nach dem Myokardinfarkt (Herzinfarkt) in das Herzmuskelgewebe eingewanderten Immunzellen vom Typ Makrophagen zu identifizieren, setzen die Forschenden den Antikörper für das CD68-Antigen ein. Dieser Antikörper ist mit einem hellen, rot-fluoreszierenden Farbstoff gekoppelt. Sobald der Antikörper an das CD68-Antigen der Makrophagen bindet, können diese Immunzellen unter dem Lichtblatt-Fluoreszenzmikroskop über die emittierten Photonen (quasi Lichtteilchen) lokalisiert werden (hier in rot-orange dargestellt). Foto: ISAS / Anika Grüneboom
© ISAS / Anika Grüneboom
Fluorophore
Ein Fluorophor ist eine fluoreszierende chemische Verbindung, die im Grundzustand Photonen absorbieren kann. Fluoreszenz beschreibt die Eigenschaft von Stoffen, kurzwelliges Licht zu absorbieren und in einer anderen Wellenlänge wieder abzustrahlen. Die Elektronen eines Moleküls werden dabei kurzzeitig angeregt, bevor sie auf ihr ursprüngliches Energieniveau zurückfallen. Dabei wird Energie frei, die wir als Licht wahrnehmen. Um bestimmte Strukturen mit einem Fluoreszenzmikroskop erkennen zu können, fügen Wissenschaftler:innen ihren Proben Fluoreszenzmarker oder Fluorochrome hinzu. Diese haften wie ein kleines Fähnchen an bestimmten Strukturen und machen diese unter dem Fluoreszenmikroskop sichtbar.
3D-Bioprinting trifft auf NMR
Für Dr. Themistoklis Venianakis aus der Arbeitsgruppe NMR Metabolomics ist die Antwort auf die Frage nach besonderen Verbindungen ebenfalls klar. „Ein perfektes Paar ist für mich die Kombination der 3D-Bioprinting-Technologie mit der Methode der Kernspinresonanzspektroskopie, Englisch Nuclear Magnetic Resonance, kurz NMR“, sagt der Chemiker. Die Forschungsgruppe NMR Metabolomics erzeugt mittels 3D-Druck dreidimensionale Zellkulturen. Diese Kulturen müssen in sehr kleine Röhrchen passen, damit sie sich unter physiologischen, also lebensnahen, Bedingungen mittels NMR analysieren lassen. Ziel ist es, Stoffwechselprozesse so quantitativ und qualitativ zu untersuchen. Das Metabolom (Gesamtheit aller Stoffwechselprodukte in einem Organismus) kann Aufschluss über mögliche Krankheitszustände im Körper geben. Um die Kombination aus 3D-Bioprinting und NMR-Analyse als unschlagbare Verbindung zu etablieren, arbeitet Venianakis aktuell daran, Strukturen zu drucken, die passgenau für das NMR sind – und gleichzeitig eine sichere Umgebung für die zu untersuchenden Zellen bieten.

Dr. Themistoklis Venianakis arbeit als Chemiker in der Forschungsgruppe NMR Metabolomics.
© ISAS

Für die Analyse mit dem NMR nutzt Dr. Themistoklis Venianakis schmale Röhren. Die milchig aussehende Probe darin besteht aus Alginat und Gelatine. Sie bildet ein Gerüst für Zellen. Damit die Zellen im Glasrohr überleben können, muss die Nährstofflösung einen neutralen PH-Wert haben. Dieser wird durch die rötliche Färbung angezeigt. Bei einem sauren Milieu würde sich die Lösung gelb verfärben.
© ISAS
Ein weiteres »perfect match«: Alginat und Gelatine
Laut Venianakis ist die größte Herausforderung, dass das Material solide genug für feste Strukturen, gleichzeitig aber noch formbar für den 3D-Druck sein muss. Auch hier spielt die perfekte Kombination eine wichtige Rolle: Alginat, ein natürlich vorkommendes Polysaccharid, sorgt für eine solide, brechsichere Struktur, während Gelatine die Mischung flexibler und weicher macht. Die beiden Stoffe fungieren wie eine Art Gerüst für die Zellen. Aus den drei Komponenten Alginat, Gelatine und Zellen erstellt der 3D-Drucker die Strukturen für die Analyse mittels NMR.
(Anna Becker / Nadine Kuhnen)