Dortmund, 12. Januar 2024
Zu den ISAS-Wissenschaftler:innen, die beim Transregio 332 forschen, gehört Darleen Hüser. Die 28-Jährige betrat mit dem Projektbeginn Neuland in puncto Neutrophilen und Imaging-Techniken. Warum sie auf unbekanntem Terrain ein knochenharter Job erwartet, berichtet die Biologin im Interview.

Darleen Hüser arbeitet als wissenschaftliche Mitarbeiterin in der Arbeitsgruppe Bioimaging. Thema ihrer Promotion sind die Immunzellen Neutrophile Granulozyten.
© ISAS / Hannes Woidich
Was sind deine Aufgaben als Doktorandin beim Transregio 332?
Hüser: Es ist zwar bekannt, dass sich die Neutrophilen bei der rheumatoiden Arthritis je nach ihrem Aufenthaltsort im Kniegelenk, etwa in der Synovialhöhle oder im Synovialfettpolster, unterscheiden. Wie sich diese Subpopulationen an Neutrophilen zusammensetzen – also wie der immunzelluläre Fingerabdruck bei rheumatoider Arthritis aussieht –, ist jedoch unklar. Ich gehe der Hypothese nach, dass die verschiedenen Neutrophilen-Subtypen unterschiedliche Entzündungsreaktionen bei den Makrophagen auslösen.
Für eine zukünftige gezielte Therapie der Erkrankung könnten diese Informationen von großer Bedeutung sein. Ziel ist es herauszufinden, wie viele Neutrophilen-Subtypen es gibt, aus welchen Subpopulationen sich das gesamte Neutrophilen-Infiltrat genau zusammensetzt und wo genau im entzündeten Gelenk die einzelnen Subtypen agieren. Dafür untersuche ich mit verschiedenen Imaging-Technologien wie der Konfokal-Mikroskopie und der Lichtblatt-Fluoreszenzmikroskopie Kniegelenke von Mäusen mit rheumatoider Arthritis.
Warum forschst du mitunter am Konfokal-Mikroskop?
Hüser: Wir möchten erfahren, wie sich die eingewanderten Neutrophilen-Subtypen in der Synovialhöhle von denen im synovialen Fettgewebe des Kniegelenks unterscheiden. Bei unseren Fragestellungen spielt diese räumliche Information eine entscheidende Rolle. Wir möchten so den Grund der verschiedenen Infiltrationsprofile erfahren. Nachdem ich das Kniegelenk unter dem Lichtblatt-Fluoreszenzmikroskop untersucht habe, bereite ich es für die weitere Analyse unter dem Konfokal-Mikroskop vor. Letzteres ermöglicht eine sehr hohe Auflösung auf subzellulärer Ebene und bringt zwei Vorteile: Erstens kann ich identifizieren, welche Neutrophilen-Subtypen in welcher anatomischen Nische vorkommen. Zweitens ermöglicht mir die Konfokal-Mikroskopie die Analyse von Zell-Zell-Interaktionen zwischen den verschiedenen Neutrophilen und den gewebeansässigen Makrophagen.
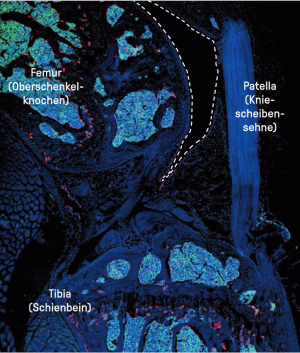
Die gestrichelten Linien umranden einen Teil der Synovialhöhle – dunkler Bereich – zwischen dem Femur (Oberschenkelknochen) und dem synovialen Fettgewebe bzw. synovialen Weichgewebe unterhalb der Patellasehne (Kniescheibensehne), bei einer gesunden Maus. Als Synovialhöhle bezeichnet man die Gelenkhöhle, die von einer dünnen Schicht der Synovialmembran auskleidet wird. Die rot angefärbten Zellen sind die Makrophagen. Im gesunden Knie bildet eine spezielle Makrophagen-Population, die synovialen Lining-Makrophagen, eine Barriere entlang der Synovialmembran. Die grün markierten Zellen sind die Neutrophilen. Die mittels Konfokal-Mikroskop gemachte Aufnahme zeigt, dass im gesunden Zustand in der Synovialhöhle keine Immunzellen zu sehen sind.
© ISAS / Darleen Hüser (Bioimaging)
Welchen Herausforderungen begegnest du bei diesem Forschungsprojekt?
Hüser: Der Mix an Imaging-Methoden ist sehr spannend, gleichzeitig ist meine Forschung ein Knochenjob. Für die Lichtblatt-Fluoreszenzmikroskopie benötige ich das Kniegelenk als transparentes intaktes Gelenk. Ich kümmere mich also zuerst um das Clearing (s. Infobox) der Knochen. Anschließend mache ich diesen Schritt rückgängig und schneide danach für die Konfokal-Mikroskopie das Gelenk händisch am Kryostat-Mikrotom in zehn bis 14 Mikrometer dünne Scheiben.
Was in der Theorie einfach klingt, ist im Labor schwierig. Zum einen, weil es für die mikroskopische Analyse von Knochen nur wenige etablierte Methoden gibt und ich erst ein passendes Protokoll für die Behandlung der Gelenke entwickeln muss. Zum anderen benötige ich gleichmäßige Schnitte – was bei einem Kniegelenk aus Knochen, weichem Synovialgewebe, Sehnen und Fettpolstern eine Herausforderung an die Schneidetechnik darstellt. Ich muss messerscharf arbeiten und darf weder zu wenig noch zu viel Druck auf die Klinge ausüben, damit die Schnitte akkurat ausfallen und es keine Knochensplitter gibt. Die Morphologie, also Form und Struktur, des Gewebes sollen bestmöglich erhalten bleiben.
CLEARING
Da Gewebe oder Knochen das Licht absorbieren, reflektieren oder streuen können, bedürfen sie für eine tiefe Einsicht jenseits der Oberfläche einer chemischen Behandlung. Das von Prof. Dr. Anika Grüneboom zu diesem Zweck entwickelte Clearing kommt am ISAS und weltweit bei der Lichtblatt-Fluoreszenzmikroskopie zum Einsatz. Bei diesem Verfahren machen Forschende mithilfe des natürlichen Aromastoffs Zimtsäureethylester die Proben transparent. Grünebooms Clearing lässt sich rückgängig machen, sodass keine Proben zerstört werden und dieselben Knochen bzw. dasselbe Gewebe sich anschließend beispielsweise unter dem Konfokal-Mikroskop untersuchen lassen.
Gibt es einen Aspekt, der deine Arbeit besonders bereichert?
Hüser: Erst mit dem Beginn des Projektes ist mir mehr und mehr bewusst geworden, wie umfassend und heterogen die Welt der Neutrophilen ist und welche vielfältige Bedeutung sie für unser Immunsystem haben. Aber vor allem: Es gibt so viel, was wir noch gar nicht über Neutrophile wissen. Außer diesem thematischen Neueinstieg waren bei Projektbeginn die meisten Imaging-Methoden für mich neu. Mich fasziniert, welche Informationen wir aus einem Kniegelenk mithilfe des Imaging-Mixes gewinnen können und welche Details dabei plötzlich sichtbar werden.
(Das Interview führte Sara Rebein.)
"TRR 332 – Neutrophile Granulozyten: Entwicklung, Verhalten & Funktion" wird durch die Deutsche Forschungsgemeinschaft (DFG) gefördert – Projektnummer 449437943.