Dortmund, 21. November 2023
Morbus Fabry ist eine tückische Erkrankung, die schleichend das Herz und andere Organe zerstört und oft erst erkannt wird, wenn es zu spät ist um noch einzugreifen. Eine neu am ISAS erprobte Diagnosemethode kann möglicherweise zukünftig dazu beitragen, dass Tausende von Leidenden allein in Deutschland früher diagnostiziert werden. Auch andere Patient:innen mit Herz-Kreislauferkrankungen – die weltweit häufigste Todesursache – könnten am Ende von den Fortschritten auf dem Gebiet profitieren.
Die Herangehensweise basiert auf der Raman-Spektroskopie, eines der neueren spektroskopischen Bildgebungsverfahren in der Biomedizin. Die biomedizinische Spektroskopie – darunter die bekannte Kernspin-Resonanz-Spektroskopie, die auf der Messung des magnetischen Moments von Kernen beruht – werde immer besser darin, Krankheiten über spezifische Biomarker zu identifizieren, sagt Prof. Dr. Kristina Lorenz, Leiterin der Abteilung Translationale Forschung und der Arbeitsgruppe Kardiovaskuläre Pharmakologie. „Wir haben eine spezielle Version der Raman-Spektroskopie, genannt kohärente Anti-Stokes-Raman-Spektroskopie oder CARS (s. Infobox) für Coherent Anti-Stokes Raman Spectroscopy eingesetzt, um zu gucken, ob wir im Herzen schon in frühen Krankheitsstadien Veränderungen erkennen können, die von Morbus Fabry verursacht werden“, erläutert die Physikerin Dr. Elen Tolstik, die seit 2018 in der Arbeitsgruppe Kardiovaskuläre Pharmakologie forscht.

Prof. Dr. Kristina Lorenz ist Pharmakologin und Leiterin der Abteilung Translationale Forschung am ISAS. In ihrer Arbeitsgruppe Kardiovaskuläre Pharmakolgie forscht sie unter anderem zu Diagnosemethoden bei Morbus Fabry.
© ISAS / Hannes Woidich
RAMAN-SPEKTROSKOPIE & CARS
Die Technologie nutzt das Phänomen der Raman-Streuung, bei der Licht von Molekülen unelastisch gestreut wird, wobei sich seine Wellenlänge verändert. Mithilfe von hochpräzisen Messungen lassen sich aus dem Prozess spezifische Informationen über die Eigenschaften der lichtstreuenden Moleküle ablesen, etwa ihre chemische Zusammensetzung, Strukturen und molekulare Dynamik. Im Unterschied zur einfachen Raman-Spektroskopie regen bei der CARS zwei intensive Laserstrahlen unterschiedlicher Wellenlänge selektiv bestimmte Molekülschwingungen an. Die resultierende kohärente Strahlung dringt mit einem deutlich höheren Signal tiefer in die Gewebeschichten ein, sodass sich große Strukturen schneller analysieren lassen.
Morbus Fabry – verschiedene Symptome erschweren Diagnose
Auslöser für Morbus Fabry ist ein Gendefekt, der bewirkt, dass im Körper zu wenig oder gar nichts von einem Enzym namens α-Galaktosidase A oder α-GAL A produziert wird. Das Enzym sitzt bei Gesunden in fast allen Zellen des Körpers und baut dort sogenannte Glykosphingolipide ab – Fettstoffe, die sich am Aufbau der Zellmembrane beteiligen. Ohne α-GAL A und den von ihm initiierten Abbau reichern sich diese Lipide an – sie werden gewissermaßen „gespeichert“ – was die Zellen auf Dauer schädigt. Morbus Fabry wird deshalb auch als Speicherkrankheit“ bezeichnet. Neben Organen wie dem Herzen und den Nieren sind oft die Blutgefäße und Nerven betroffen.

Fängt man früh mit der Behandlung an, haben die Patient:innen gute Überlebenschancen, aber meist wird die Krankheit zu spät diagnostiziert. Die späte Diagnose war einer der wichtigsten Gründe für uns, diese Forschung zu betreiben.
Dr. Elen Tolstik
Die Gewebeschäden durch die Lipid-Anreicherungen machen sich teils schon im Teenager:innenalter durch starken Gelenkschmerzen und Hautveränderungen bemerkbar. Typisch sind etwa rötlichviolette Knoten und Verfärbungen am Unterleib. Aber die Stoffwechselstörung kann auch individuell ganz unterschiedliche Symptome verursachen, was die Diagnose erschwert. Manche Betroffene bekommen Hornhautablagerungen in den Augen, andere entwickeln abnorm geschlängelte Blutgefäße im Gehirn und Schlaganfälle. Auch Durchfall, Schwindelattacken und Tinnitus zählen zu den Folgen von Morbus Fabry. Weit verbreitet sind zudem Schädigungen im Herzen und in den Nieren, die oft zu Herzrhythmusstörungen, Herzschwäche (Herzinsuffizienz) und Nierenversagen führen bis hin zur Notwendigkeit einer regelmäßigen Dialyse.
Viele Morbus-Fabry-Patient:innen werden nach Aussage der bundesweiten Morbus Fabry Selbsthilfegruppe bereits als junge Erwachsene ganz oder teilweise arbeitsunfähig. Geschätzt leiden in Deutschland rund 8.000 Menschen unter der Krankheit. Da der verantwortliche Gen-Defekt auf dem X-Chromosom sitzt, von dem Männer eine Kopie und Frauen zwei besitzen, sind Männer überdurchschnittlich häufig betroffen.
Frühe Therapie sichert Überlebenschance
Zwar gibt es mittlerweile eine Handvoll von pharmakologischen Therapien, die den Krankheitsverlauf mildern oder sogar umkehren können. Allerdings sind sie nur effektiv, wenn sie eingesetzt werden, bevor sich größere Gewebeschäden etabliert haben. „Fängt man früh mit der Behandlung an, haben die Patient:innen gute Überlebenschancen, aber meist wird die Krankheit zu spät diagnostiziert und das Herz ist bereits von Fibrosen, also krankhaften Gewebeveränderungen, zerstört“, sagt Tolstik. „Die späte Diagnose war einer der wichtigsten Gründe für uns, diese Forschung zu betreiben.“
Prinzipiell können Blut- und Gentests zeigen, ob das wichtige Enzym α-GAL A im Körper vorhanden ist oder ein Gendefekt vorliegt. Doch möglicherweise bereits vorhandene Schädigungen im Körper werden trotzdem oft erst spät erkannt. „Neue Biomarker und/oder Diagnosemethoden für Morbus Fabry-verursachte Folgen im Herzen sind dringend erforderlich“, schreiben Lorenz und Tolstik in einem Fachartikel über ihr Projekt im International Journal of Molecular Sciences. In enger Kooperation mit dem Kardiologen PD Dr. Peter Nordbeck vom Universitätsklinikum Würzburg, das ein international anerkanntes Kompetenz- und Referenzzentrum für Morbus Fabry unterhält, testeten die beiden ISAS-Forscherinnen die Analyse mittels CARS.
Molekulare Signatur mithilfe von CARS entschlüsseln
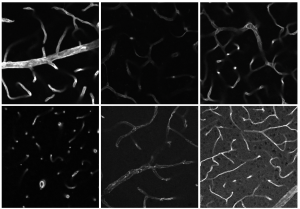
Bislang haben die beiden Forscherinnen das CARS-Verfahren im Mausmodell (α-GAL A Knockout-Mäuse; s. Infobox) und gesunden Tieren getestet. Unterstützt durch eine anspruchsvolle Computer-Datenverarbeitung ließen sich bei den Biopsien der Knockout-Mäuse bereits subtile Veränderungen im Protein-Lipid-Gehalt des Herzgewebes mit einer Sensitivität von bis zu 96 Prozent feststellen. Das heißt, dass die krankhafte Speicherung von Lipidstoffen im Gewebe – die molekulare Signatur von Morbus Fabry – mittels CARS auch ohne aufwändige histologische Untersuchungen erkannt werden kann, noch bevor das betreffende Organ stark geschädigt ist.
KNOCKOUT-MAUS
Mäuse kommen aufgrund ihrer biologischen und genetischen Ähnlichkeit mit dem Menschen in der Forschung häufig zum Einsatz. Bei einer Knockout-Maus schalten Wissenschaftler:innen ein bestimmtes Gen oder mehrere Gene sprichwörtlich aus. Mithilfe der genetisch veränderten Tiere können sie anschließend ein bestimmtes Krankheitsmodell untersuchen. Für die Forschung zu Morbus Fabry sind dies Knockout-Mäuse, bei denen das Gen für die Produktion von α-GAL A außer Gefecht gesetzt wurde.
Als nächsten Schritt planen Lorenz und Tolstik, das Diagnoseverfahren in Humanproben zu testen. Bewährt sich die Methode weiterhin, kann sie im Prinzip auch bei anderen ähnlichen Erkrankungen eingesetzt werden, gegebenenfalls in Kombination mit weiteren bildgebenden Verfahren. Die Forschenden am ISAS bauen damit weitere Kompetenzen in dem so wichtigen neuen Gebiet aus, mithilfe bildgebender Verfahren neuartige Biomarker für Herzkreislauf-Erkrankungen zu finden. Kollektiv töten diese Erkrankungen rund 18 Millionen Menschen jährlich in der Welt – mehr als jede andere Todesursache. Als nicht-zerstörerische Tools, die Einblick in die chemische Zusammensetzung von Gewebe und Flüssigkeiten geben, könnten der Raman- und CARS-Spektroskopie potenziell eine Schlüsselrolle in der kardiovaskulären Forschung zukommen.
(Ute Eberle)