Dortmund, 8. November 2024
Entzündungs- oder Abstoßungsreaktionen, beispielsweise nach einem Herzinfarkt bzw. einer Organtransplantation, sind hochkomplexe immunologische Prozesse. Um diese ganzheitlich zu verstehen, ist es notwendig, die biologischen Strukturen vom ganzen Organ über einzelne Zellen bis hin zur molekularen Ebene zu analysieren – wie bei einer Matroschka-Puppe. Dafür arbeiten im Projekt »KI-assistierte Bildgebung von großen Geweben« mehrere ISAS-Forschungsgruppen an der Kombination verschiedener mikroskopischer und massenspektrometrischer Verfahren. Das interdisziplinäre Team setzt dabei murine (von Mäusen stammende) sowie humane Proben ein. Diese kommen von klinischen Kooperationspartnern wie der Charité – Universitätsmedizin Berlin sowie dem Universitätsklinikum Essen. Ziel des Projekts: skalenübergreifende Analysen, um aus ein- und derselben Probe detaillierte Informationen über die zelluläre Zusammensetzung und Wechselwirkungen innerhalb eines Gewebes zu erlangen.
So sind nicht nur präzisere, sondern auch ressourcenschonendere Analysen als bisher möglich: Die Kombination verschiedener Mikroskopie-Verfahren (inkl. einer speziellen Clearing-Methode, die Organe transparent macht (s. Infobox) plus Künstliche Intelligenz (KI) für die Analyse der Aufnahmen trägt dazu bei, die Zahl der Proben signifikant zu reduzieren. Außerdem arbeiten KI-Expert:innen daran, den Energieverbrauch für die Datenspeicherung zu minimieren und trotzdem die Analyse-Qualität der ultrahochauflösenden Mikroskop- Aufnahmen zu erhöhen.
Das Matroschka-Prinzip
Das Prinzip der Forschenden ähnelt dem der Matroschka-Puppen. Statt auf immer kleinere, verschachtelte Holzpuppen blickt das ISAS -Team mit jedem Schritt tiefer in die biologischen Strukturen einer Probe hinein. Angefangen bei ganzen Organen bis hin zu den molekularen Details ermöglicht dieser Ansatz ein präzises Verständnis der biologischen Prozesse.


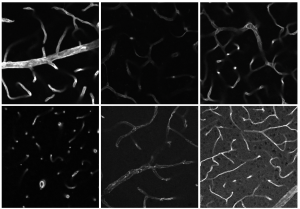
Bevor es mittels Massenspektrometrie tief in die molekularen Strukturen geht, analysieren die Forschenden verschiedene Gewebeproben zunächst im Ganzen. Mithilfe des Lichtblatt-Fluoreszenzmikroskops („Lightsheet“) schaut sich Doktorandin Flora Weber beispielsweise intakte Organe wie Nieren oder Knochen von Mäusen an. Im Mikroskop beleuchtet eine dünne Lichtscheibe die einzelnen Ebenen einer mithilfe des Clearings transparent gemachten Probe und macht jeweils eine Aufnahme. Die Forschenden erhalten durchschnittlich etwa 500 Bilder pro Probe und setzen diese anschließend am Computer zu einem 3D-Modell zusammen. Im Anschluss machen sie das Clearing rückgängig, sodass dieselbe Probe am Konfokalmikroskop analysiert werden kann. Zwar müssen die Wissenschaftler:innen Organe oder Gewebe hierfür in Scheiben schneiden, doch nur so werden die zellulären Details durch die optisch höhere Auflösung des Konfokalmikroskops sichtbar. Bei der Mikroskopie entstehen andere Daten als beispielsweise bei der Massenspektrometrie. Durch die Kombination der verschiedenen Methoden möchten die Forschenden perspektivisch sogenannte multimodale Daten generieren. Die Integration und Analyse dieser aus verschiedenen Datentypen bestehenden Informationen erfolgt am ISAS in Kooperation mit den Nachwuchsgruppen AMBIOM – Analysis of Microscopic BIOMedical Images und Mehrdimensionale OMICS-Datenanalyse.
© ISAS / Hannes Woidich

Mithilfe des Durchflusszytometers analysiert Dr. Martin Stenzel einzelne Zellen in hohem Tempo. Auf dem Bild bringt er eine flüssige Probe, in diesem Fall Blutzellen eines Tumorpatienten, in das Gerät ein. Dort führt sie ein schmaler Flüssigkeitsstrom an verschiedenen Laserquellen vorbei. Sobald die Zellen den Lichtstrahl durchqueren, erfassen Sensoren das unterschiedlich gestreute und ausgestrahlte Licht einschließlich Strahlung im sichtbaren Wellenlängenbereich und Fluoreszenzstrahlung. Die Signale verraten genau, welche Zelltypen und Zellbestandteile in der Probe vorhanden sind und in welcher Menge. Um die Durchflusszytometrie in den Workflow zu integrieren, entwickelt die Arbeitsgruppe Bioimaging derzeit eine alternative Probenvorbereitung für die Lichtblatt-Fluoreszenzmikroskopie. Für Letztere müssen sie die Proben zunächst fixieren, also die Zellen oder Gewebestrukturen chemisch stabilisieren, damit sie während der Analyse ihre Form und Position beibehalten. Der neue Ansatz der Forschenden zielt auf ein reversibles Verfahren zur Fixierung ab, sodass sie Teile derselben Probe anschließend mittels Durchflusszytometrie analysieren können.
© ISAS / Hannes Woidich

Die Forschenden testen ihren Workflow anhand verschiedener Proben, darunter murine Herzen sowie murine und humane Nierenproben im Kontext von Reperfusionsschäden. Diese treten auf, wenn sich der Blutfluss in einem Gewebe nach einer Unterbrechung wiederherstellt. Dies ist zum Beispiel nach einem Herzinfarkt oder einer Nierentransplantation der Fall, wenn verschlossene Gefäße sich wieder öffnen. Das Bild zeigt murine Kieferknochen aus einem Modell der medikamentenassoziierten Kieferosteonekrose (Medication-Related Osteonecrosis of the Jaw, MRONJ). Dabei sterben Teile des Kieferknochens ab, zum Beispiel aufgrund von Arzneimitteln gegen eine Osteoporose. Mithilfe eines von Prof. Dr. Anika Grüneboom entwickelten Clearing-Verfahrens machen die Forschenden die Knochen für die Analyse mit dem Lichtblatt-Fluoreszenzmikroskop zunächst transparent (im Bild rechts). Knochengewebe ist sehr heterogen: Während der kortikale Knochen, die äußere Schicht, hart ist, ist das Knochenmark im Inneren vergleichsweise weich. Dazu kommen Knorpelgewebe, Sehnen und Muskeln an den äußeren Knochengrenzflächen. Die diversen Gewebetypen benötigen jeweils angepasste chemische Aufbereitungen, um sie für die verschiedenen Analysemethoden zugänglich zu machen. Die Wissenschaftler:innen forschen daher an einem Ansatz, der die konträren Anforderungen an die Probenvorbereitung innerhalb des Workflows vereint.
© ISAS / Hannes Woidich
Clearing
Gewebe und Knochen können Licht auf verschiedene Weisen beeinflussen: Sie können es absorbieren, reflektieren oder streuen. Um eine Probe jenseits der Oberfläche mit dem Lichtblatt-Fluoreszenzmikroskop im Ganzen untersuchen zu können, müssen Forschende sie daher zunächst chemisch behandeln. Prof. Dr. Anika Grüneboom hat zu diesem Zweck ein Verfahren entwickelt, das die Proben mithilfe des natürlich vorkommenden Aromastoffs Zimtsäureethylester transparent macht. Das optische Clearing lässt die Proben intakt und ist reversibel. So können Wissenschaftler:innen dieselben Knochen bzw. dasselbe Gewebe anschließend beispielsweise unter dem Konfokalmikroskop untersuchen.