Dortmund, 4. November 2021
Wenn Flora Weber ihre Proben unter dem Mikroskop anschaut, blendet sie alles um sich herum aus: Eine Fähigkeit, die sich die Doktorandin bei ihrem Hobby, dem Klettern, angeeignet hat. Seit dem 1. Juli 2021 forscht sie in der Arbeitsgruppe Bioimaging an einem durch Medikamente verursachten Absterben des Kieferknochens. Zuvor hat die 25-Jährige Biologie studiert und ihren Master im internationalen Programm “Integrated Immunology” an der Friedrich-Alexander-Universität Erlangen-Nürnberg gemacht. Warum es wichtig ist, sich besonders in der Mikroskopie keineswegs nur auf die Details zu konzentrieren, erklärt die Biologin im Interview.

Durch die Kombination verschiedener Imaging-Methoden für die Analyse von Zellen erhält Flora Weber, hier am Konfokalmikroskop, Informationen über größere Zusammenhänge und spezifische Details.
© ISAS
Wieso bist du ans ISAS gekommen?
Weber: Ich habe Prof. Dr. Grüneboom, die inzwischen meine Arbeitsgruppe hier am ISAS leitet, schon während meiner Masterarbeit kennengelernt. Dort hat sie mich in die bildgebenden Methoden wie die Lichtblatt-Fluoreszenzmikroskopie, die ich heute nutze, eingearbeitet. In meiner Arbeit ging es um den Knochenumbau in Mäusen. Ich habe mich viel mit Knochenzellen, also Osteoblasten und Osteoklasten, beschäftigt. Das Thema hat mir sehr gut gefallen, sodass ich für meine Promotion ans ISAS gekommen bin. Hier bekomme ich die Chance, in diesem Bereich weiter zu forschen.
Was ist das Ziel deiner Forschung?
Weber: Ich forsche an der Medikamenten-assoziierten Kieferosteonekrose (Medication-Related Osteonecrosis of the Jaw, MRONJ). Bei dieser Erkrankung sterben Teile des Kieferknochens ab – etwa durch Arzneimittel gegen eine Osteoporose. Die Medikamente, meist sogenannte Bisphosphonate, verhindern zwar den Knochenabbau durch die Osteoporose, aber wir wissen noch nicht, wieso sie MRONJ auslösen. Auch Krebspatient:innen, die durch eine Strahlentherapie ein hohes Osteoporose-Risiko haben, bekommen diese Medikamente in hoch dosierter Form. Daher leiden auch sie sehr häufig an MRONJ.
Um die Mechanismen der Erkrankung verstehen zu können, möchte ich herausfinden, wie die Zellen des Knochengewebes mit den Zellen der Blutversorgung interagieren. Dabei konzentriere ich mich auf die Verbindung zweier Vorgänge: Wenn sich neue Knochen bilden (Osteogenese) und wenn Blutgefäße aus vorbestehenden Blutgefäßen entstehen (Angiogenese). Dieses sogenannte Osteogene-Angiogene Coupling im Kieferknochen vergleiche ich anschließend mit dem im Schienbeinknochen, da Letzterer nicht von MRONJ betroffen ist. Warum MRONJ nur den Kieferknochen betrifft, ist unbekannt. Wenn es uns gelingt, die Unterschiede der Zellstrukturen in Kiefer und anderen Knochen wie etwa Schienbeinknochen zu bestimmen, wäre das eine Chance der Entwicklung von MRONJ vorzubeugen oder therapeutische Ansätze gegen eine Osteoporose zu entwickeln, die keine der beschriebenen Nebenwirkungen hervorrufen.
Welche Analysemethoden spielen für deine Arbeit eine Rolle, wie gehst du vor?
Weber: Um die Erkrankung beim Menschen besser verstehen zu können, schaue ich mir die Kiefer- und Schienbeinknochen von Mäusen mit MRONJ an. Dazu nutze ich verschiedene Mikroskope, beispielsweise das Lichtblatt-Fluoreszenzmikroskop oder das Konfokalmikroskop. Je nachdem welches Mikroskop ich einsetze, wende ich ein Clearing Protokoll von Prof. Dr. Grüneboom an, das Knochen transparent macht. Das ist notwendig, um die Lichtstreuung beim Mikroskopieren zu reduzieren und so optisch tiefer in das Gewebe einzudringen.
Weshalb arbeitest du an verschiedenen Mikroskopen?
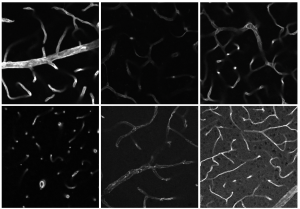
Weber: Es ist sehr wichtig, nicht nur die Details, sondern auch größere Zusammenhänge unter die Lupe zu nehmen. Das Lichtblatt-Fluoreszenzmikroskop – oder Lightsheet, wie wir es nennen – ist zum Beispiel geeignet, um ganze Organe oder einen kompletten Knochen abzubilden. Es macht viele einzelne Aufnahmen der jeweiligen Ebenen, die ich dann zu einem 3D-Modell zusammenfüge. So erhalte ich eine Gesamtübersicht und kann sehen, wie sich die Zellen beispielsweise zueinander abgrenzen. Mit dem Konfokalmikroskop schaue ich mir danach spezifische Details an. Dafür muss ich den Knochen in dünne Scheiben schneiden. Deswegen funktioniert diese Analyse ohne das Clearing. Der Vorgang ist übrigens reversibel, ich kann das Clearing also rückgängig machen und mir die selbe Probe unter verschiedenen Mikroskopen anschauen. Das ist sehr wichtig, da ich viel Wert darauflege, nachhaltig mit den Ressourcen umzugehen.
Wie wertest du die Bilder anschließend aus?
Weber: Ich nutze verschiedene Programme für die Auswertung. Das Hauptprogramm ist IMARIS, eine Software zur Bildanalyse. Damit ich die Zellen unterscheiden kann, färbe ich zelltypische Proteine mit fluoreszierenden Antikörpern als Marker an. Bei Oberflächenmarkern sehe ich zum Beispiel die Zellumrandung, bei intrazellulären Markern liegt der Fokus auf den inneren Strukturen. Je nach Marker wird das Signal in einem unterschiedlichen Wellenlängenbereich erkannt und erscheint auf dem Computer in einer anderen Farbe. So versuche ich, Unterschiede in der räumlich-zeitlichen Verteilung der Zellen zu finden. Im Idealfall kann ich sehen, wie die Strukturen aussehen und ob die Zellen miteinander kommunizieren.
Was fasziniert dich am Imaging?
Weber: Imaging begeistert mich sehr, weil es sprichwörtlich so greifbar ist. Ein Bild zeigt mir auf einen Blick alle wichtigen Informationen. Die räumliche Verteilung der Zellen oder ihre Proteinprofile lassen sich beispielsweise in einem Funktionsgraphen nur schwer darstellen. Außerdem finde ich Knochen unglaublich spannend, weil sie komplex sind. Anfangs dachte ich immer, das Immunsystem besteht nur aus B-Zellen und T-Zellen. Also den Zellen, die eine Immunantwort erzeugen, wenn man zum Beispiel einen Infekt hat. Aber auch die Osteoklasten und andere knochenassoziierten Zellen gehören zum Immunsystem. Genau wie die anderen Immunzellen entstehen sie im Knochenmark und reagieren auf Entzündungen und Störungen.
Wie verbringst du deine Zeit außerhalb des Instituts?
Weber: Ich treffe Freunde und mache viel Sport. Am liebsten gehe ich Bouldern - wenn es das Wetter zulässt, bin ich auch gerne draußen an Felsen. Beim Klettern muss ich meine Ängste überwinden und dazu bereit sein, Grenzen auszutesten. Eigentlich genau wie in der Forschung. Auch beim Imaging im Labor muss ich Herausforderungen meistern und bereit sein, Neues zu wagen.
(Cheyenne Peters)