Dortmund, 3. Dezember 2021
Man stelle sich vor, das Nerven- oder Herz-Kreislauf-System ließe sich während seiner Arbeit von außen beobachten. Ein transparenter Mensch wäre damit nicht nur unglaublich spannend, sondern könnte sicherlich auch viele medizinische Fragen zur Genese, Früherkennung oder Therapie von Erkrankungen klären. Denn biologische Strukturen sind unglaublich komplex. Sie bestehen aus verschiedenen Geweben mit unterschiedlichen Eigenschaften.
Transparenz ist das Ziel von Prof. Dr. Anika Grüneboom. „Wir brauchen zerstörungsfreie und sichere Methoden, die es uns erlauben, tief in den Körper hineinzuschauen“, erläuterte die Immunologin und Leiterin der Arbeitsgruppe Bioimaging am ISAS. Um die Herausforderungen und Chancen dieser Methoden ging es am 22. November 2021 in der HealthTech-Lecture „Der Werkzeugkasten der Fluoreszenzmikroskopie – Brückenschlag in die Immunologie“ des Forschungsverbunds Leibniz Gesundheitstechnologien.
Kein „One size fits all“ in der Mikroskopie
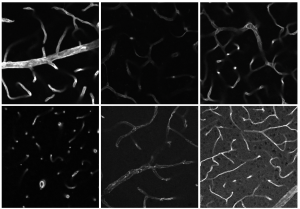
In Grünebooms Werkzeugkasten gibt es viel zu entdecken. Damit sie den diversen optischen Herausforderungen biologischer Strukturen gerecht werden, kombinieren die Forscherin und ihr Team verschiedene Mikroskopie-Techniken. „Es gibt bisher keine Methode, die sämtliche Größenordnungen in biologischen Proben umfasst“, sagte die Biologin. Um beispielsweise eine Infektion und die entsprechende Immunreaktion zu verstehen, ist es notwendig den Prozess aus verschiedenen Blickwinkeln zu betrachten. Eine der Imaging-Techniken, die Grüneboom nutzt ist die Fluoreszenzmikroskopie (siehe Infobox). Zu dieser Form der Lichtmikroskopie zählt unter anderem die Lichtblatt-Fluoreszenzmikroskopie. Hier beleuchtet ein Laser jeweils nur eine dünne Schicht der Probe, beispielsweise Gewebe, ohne sie dabei zu zerstören. Aus den vielen einzelnen Bildern, entsteht später am Computer ein 3D-Modell der ganzen Probe. Doch ganz so einfach liefert die Lichtblatt-Fluoreszenzmikroskopie allein kein „gläsernes“ Ergebnis.
HealthTech-Lecture: Der Werkzeugkasten der Fluoreszenzmikroskopie (Prof. Anika Grüneboom, ISAS)
Grünebooms patentiertes Clearing ist weltweit im Einsatz
Da etwa Gewebe das Licht absorbieren, reflektieren oder streuen kann, verhindert es ohne chemische Behandlung eine tiefere Einsicht jenseits der Oberfläche. Deswegen arbeitet Grüneboom mit einem von ihr entwickelten Clearing-Verfahren. Mithilfe von Zimtsäureethylester, einem natürlich vorkommenden Aromastoff, macht sie ihre Proben transparent, bevor sie diese mikroskopiert. So gelang es der Biologin 2019, eine bis dato unbekannte anatomische Struktur zu entdecken: Blutgefäße, die den kortikalen Knochen von Mäusen durchziehen und als kleine „Autobahnen“ für Immunzellen aus dem Knochenmark dienen. Das Besondere an Grünebooms Technik, die Forscher:innen weltweit nutzen: Das Clearing lässt sich rückgängig machen, sodass keine Proben zerstört werden. Außerdem ist ihr Verfahren für den Laboralltag ungefährlich, da es auf giftige und krebserregende sowie explosionsgefährliche Chemikalien verzichtet.
Transparenter Mensch – kein Science-Fiction?
Die Lichtblatt-Fluoreszenzmikroskopie bietet mit den passenden „Werkzeugen“ – in dem Fall Grünebooms Clearing – als Analysemethode enorme Chancen. Um Immunerkrankungen oder Thrombosen besser verstehen und künftig schneller diagnostizierbar machen zu können, forscht die Arbeitsgruppe Bioimaging an Proben von Mäusen. Auf die Frage eines Teilnehmers, wie es mit menschlichen Proben aussehe, antwortete Grüneboom: „Grundsätzlich kann man das Clearing auch auf menschliche Gewebeproben übertragen“.
Künstliche Intelligenz revolutioniert die Auswertung
Nicht nur für die anwendungsorientierte Grundlagenforschung ist Grünebooms Methode relevant. Auch um diagnostische Verfahren zu optimieren, lässt sich die Fluoreszenzmikroskopie verwenden. Beispielsweise um Veränderungen in kleinen Gefäßknäulen (Glomeruli) in der Niere festzustellen. Anstatt wie üblich histologische Schnitte der Niere anzufertigen und per Hand zu vermessen, kann ein Algorithmus aus den Bildern des Fluoreszenzmikroskops jedes einzelne der etwa 15.000 Glomeruli einer Niere erkennen, zählen und analysieren. „Künstliche Intelligenz erlaubt uns eine wesentlich präzisere Statistik, da wir nicht nur einen Ausschnitt, sondern das ganze Organ sehen können“, sagte Grüneboom. Der Herausforderung, die so entstehenden enorm hohen Datenmengen zu analysieren, stellt sie sich gemeinsam mit der neuen, auf künstliche Intelligenz spezialisierten ISAS-Arbeitsgruppe AMBIOM (Analysis of Microscopic BIOMedical Images) unter der Leitung von Dr. Jianxu Chen.

© ISAS
Grundsätzlich kann man mein Clearing auch auf menschliche Gewebeproben übertragen
Leibnitz-Institut für Analytische Wissenschaften – ISAS – e. V.
Wie entsteht Fluoreszenz?
Fluoreszenz beschreibt die Eigenschaft von Stoffen, kurzwelliges Licht zu absorbieren und in einer anderen Wellenlänge wieder abzustrahlen. Dabei werden die Elektronen des Moleküls kurzzeitig angeregt, bevor sie auf ihr ursprüngliches Energieniveau zurückfallen. Dabei wird Energie frei, die wir als Licht wahrnehmen. Um bestimmte Strukturen mit einem Fluoreszenzmikroskop erkennen zu können, färben Forscher:innen Proben mit Fluoreszenzfarbstoffen, die die oben genannten Eigenschaften besitzen, an. Es gibt auch Stoffe, die von Natur aus fluoreszieren, sie sind autofluoreszent.
(Cheyenne Peters)
Über Anika Grüneboom
Prof. Dr. Anika Grüneboom (35) leitet am ISAS seit 2020 die Arbeitsgruppe Bioimaging und hat seitdem an der Universität Duisburg-Essen (UDE) eine Professur für ‚Experimentelle Biomedizinische Bildgebung‘ inne. Die gebürtige Essenerin absolvierte ihr Biologie-Studium von 2006 bis 2011 an der RWTH Aachen. Für ihre Promotion (2017) wechselte sie ans Universitätsklinikum Essen. Bevor sie an die UDE berufen wurde, war sie seit 2017 Gruppenleiterin am Universitätsklinikum Erlangen und untersuchte dort mithilfe bildgebender Verfahren rheumatologische und immunologische Fragen. Für ihre Forschungsarbeiten hat Grüneboom mehrfach Auszeichnungen erhalten.